人工細胞・人工細胞膜

突然ですが,細胞を人工的につくることはできるでしょうか?人類は科学と工学を急速に発展させて,すばらしい(賛否あるにせよ)文明を 築きました.これまでの人類の英知を結集すれば,生物の最も基本的な単位である細胞はできてしまうのでしょうか?結論からいくと, 自発的に増殖してさらに進化するような人工細胞はまだできていませんが,2010年にクレイグ・ベンター氏がコンピュータでデザインした DNAを持つ生物をつくったと発表して世界を騒がせたように,細胞の機能の一部を改変したり再構成したりということはかなり できるようになってきています.
当研究室では,細胞膜のモデルであるリポソーム(リン脂質二重膜小胞)に関する研究を行っています.これは,細胞の内部と外部を わけ隔てる重要な構成要素です.過去の研究において, リポソームがあたかも細胞分裂のように自発的に分裂形状に変化する物理現象を報告しました.真核生物の細胞分裂は,様々なタンパク質 がきっちりと制御して起こりますが,そのような制御がない細胞膜モデルでも「なんとなく」分裂することができるのです. 今後は,DNAと膜が協同して増殖する人工細胞や,組織的に集合して多細胞生物のようにふるまう人工細胞膜の創生に チャレンジしていきたいと考えています.
また,リポソームは,様々なバイオテクノロジーへの応用も期待されています.リポソームは化学・生体分子を内封することができるため, 薬剤やDNAなどを運ぶキャリアとして使われます.また,膜タンパク質を挿入すれば,細胞が外界に応答するインターフェースを模擬 することもできます.従って,人工細胞(膜)を研究する中で,それを制御する技術が生まれてくれば,再現性の良い効率的な バイオテクノロジーへと発展することが期待できます.しかし,分子が自己組織化してできるやわらかい構造体であるリポソームは, 従来の「硬い」機械技術では扱うことが難しいといえます.脂質膜がみせる物理現象をつぶさに観察して,さらにマイクロ技術で アシストすることで,人工細胞膜を自在に操る技術開発をしていきたいと考えています.
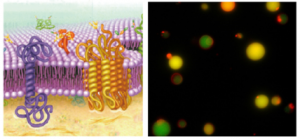
細胞膜の構造(左)とそれを人工的に再現したモデル細胞膜(右).
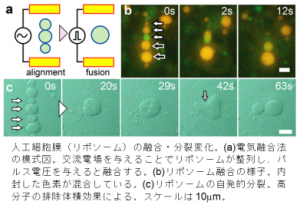
細胞分裂に似た現象を物理的に再現した様子.
introduction of liposomes and artificial cells
Conversation: artificial cells
まんが: 人工細胞

個別の研究テーマ
テーマ1:カプセル化,均一リポソーム
細胞やオルガネラは,脂質二重膜でできた膜で包まれています.この構造を,シンプルな材料組成で人工的につくったものがリポソームです.これは,生体適合性の高いカプセルで,作り方を工夫すると,いろいろな物質を封入することができます.
リポソームのカプセル利用は,薬物を体内の特定位置に送達するドラッグデリバリーシステム(DDS)の分野で広く研究されています.COVIDのパンデミックで急速に認可されたmRNAワクチンは,抗原タンパク質をコードしたmRNAが脂質で包み込まれたもので,マイクロ流路を使って生産されています.
私たちは,類似の技術を,より大きなジャイアントリポソームの製造に応用しています.サイズが細胞に近いため,人工的な細胞モデルとして利用し,細胞の基本的性質がどのような前提条件から生じるのかという問いに答える研究を行っています(K. Nishimura et al., ACS Synth. Biol., 2014).また,そのためには,サイズや構造を制御したリポソームをつくる技術が必要です.そのため,フィルターを用いてサイズが整ったリポソームを精製したり(Shinohara et al., Chem. Phys. Lipids, 2021),マイクロ流路を用いて均一なリポソームを製造する技術の開発を行っています(Ushiyama et al., submitted).これらの技術がバイオ研究で広く使われるようになる日が近いと確信しています.
テーマ2:バイオリアクター
細胞は,高度に複雑化した,色々な反応を同時に行えるバイオリアクターです.いろいろな生体分子の合成や分解,変換など,いわゆる代謝反応が,細胞内での場所,タイミングがうまく制御されて起こっています.脂質二重膜はそのカプセルとしての役割を持っています.これを真似した人工反応場をつくるのが私たちの目標です.代謝反応は,酵素と呼ばれるタンパク質によって起こります.そのため,酵素と材料やエネルギーとなる分子を一緒にリポソームの中に入れると,その中でタンパク質やDNAなどをつくることができます.
細胞と同程度のサイズの反応場は,マイクロ流路を使って作製した油の中の均一な水滴(油中水滴)でも代用することができます.この技術は商用化され,生命科学や医薬学の基礎研究でたくさん使われるようになってきました.しかし,反応場の外側が油だと,完全に閉じ込められた空間になってしまい,必要な材料や栄養の供給もできません.細胞はその外側が水性の環境であり,脂質膜を通していろいろな物質を選択的に取り込んだり,排出したりして,生きた状態を維持しています.小さな分子は脂質膜上にある膜タンパク質がその役割を果たしています.油中水滴ではなく,リポソームを人工反応場として使うことで,細胞のこのような特徴を再現したバイオテクノロジーの開発を目指しています(Tsugane et al., Sci. Rep., 2018; Okano et al., ACS Synth. Biol., 2018).
テーマ3:リポソームの変形,膜融合,分裂
リポソームをつくると,通常はまんまるな球形になります.一方で,細胞やその中のオルガネラ(ミトコンドリアやゴルジ装置など)はいろいろな形をしています.脂質二重膜は非常に柔らかく,ナノメートルの曲率半径で曲がることができるので,実に多彩な形態をとることができます.
リポソームの外側に高濃度の塩水や砂糖水を加えると,浸透圧によってその内側から水が抜けます(脂質二重膜はゆっくりですが水分子を通します).その結果,膜はいろいろな形に変化できるようになり,チューブ状,ダンベル状などの形が現れます.私たちは,巨大なリポソームに,静かにゆっくりと浸透圧を与えると,チューブが放射状に広がった神経細胞のような形態に変化することを発見しました(Koseki et al, Langmuir, 2020).細胞の形は,材料力学の観点から生じやすい形になっていると考えられます.また,細胞の形は,その内部や環境に含まれる分子によっても大きな影響を受けます.生きた細胞は,細胞骨格や,膜に付着して曲率を生じさせるタンパク質がかたちを制御しています.それだけではなく,糖やイオンなどのより基本的な分子でも,膜の両側にその濃度差があれば,膜に曲率が生じることがわかっています.私たちは,膜をはさんで高分子の濃度差がある,つまり,分子の混み具合(分子混雑)に差があるときに,膜に曲率が生じて,膜の出芽や分裂が誘発されます(Terasawa et al., PNAS, 2012; Okano et al., ACS Synth. Biol., 2018).この効果を利用して,ゲノムサイズのDNAを微小な膜で包み込む現象が起こることも示しました(Tsugane & Suzuki, ACS Synth. Biol., 2020).また,巨大なリポソームは,小さな分子だけではなく,マイクロメートルサイズの粒子も効率的に封入ができ,その放出を電気的に制御できることも示しました(Katsuta et al., Langmuir, 2019).
加えて,上のテーマ1では,細胞は細胞膜を介して選択的に物質の出入りを制御していると述べました.さらには,細胞は,膜の融合や切断を巧みに制御することで,より大きな物質や粒子の出入りも制御しています.私たちは,リポソームの膜融合や切断を,電気的,または,物理的に行い,あたかも細胞の様に効率的な物質の流入出を可能にするダイナミックなバイオリアクターの開発に取り組んでいます(Shiomi et al., PLoS ONE, 2014).
テーマ4:多細胞化
原始的な生物は単細胞ですが,高度な生物は複数またはたくさんの細胞が寄り集まって,さらに役割分担(分化)をして,単細胞では得られない機能を獲得しています.このような現象を模擬した研究は世界でもはじまったばかりですが,細胞の進化を物理・工学の観点から眺め,学び,新しいバイオテクノロジーの開発につなげたいと考えています.
本研究テーマは,以下の研究資金により補助していただきました





